Testul este compus din următoarele:
- Factorul de crestere placentar (PlGF)
- Tirozin kinaza-1 fms-like solubila (sFLt-1)
- Raport sFlt-1/PlGF
Definiții și epidemiologie
Preeclampsia (PE) este o afecțiune hipertensivă specifică sarcinii cu afectare multisistemică ce este caracterizată prin hipertensiune arterială (HTA) și proteinurie de novo apărute după săptămâna 20 de sarcină. Deși definiția clasică a PE include prezența celor două criterii (HTA și proteinurie), unele gravide manifestă HTA și semne de afectare multisistemică ce indică severitatea bolii fără ca proteinuria să fie detectată.
De aceea, în absența proteinuriei, PE este diagnosticată pe baza HTA asociată cu trombocitopenie (nr. de trombocite < 100 000/μL), semne de disfuncție hepatică (dublarea nivelului transaminazelor serice față de valorile de referință), apariția de novo a unei disfuncții renale (valori ale creatininei serice peste 1.1 mg/dL sau dublarea nivelului creatininei serice în absența unei boli renale), edem pulmonar, sau tulburări cerebrale/vizuale recent instalate1;2.
HTA este definită fie printr-o TA sistolică ≥ 140 mm Hg sau diastolică ≥ 90 mm Hg, fie prin ambele. Proteinuria este diagnosticată în prezența unei excreții urinare ≥ 300 mg/24 h sau a unui raport proteine/creatinină ≥3, măsurat într-o probă de urină spontană. Testarea calitativă a proteinuriei cu strip-urile urinare are o rată ridicată de rezultate fals-pozitive și fals-negative și de aceea va fi rezervată doar cazurilor în care determinările cantitative nu sunt disponibile2. Formele de PE severă includ oricare din următoarele semne și simptome:
- TA sistolică ≥ 160 mm Hg sau diastolică ≥ 110 mm Hg la două măsurători efectuate la interval de minimum 6 h, la gravidele cărora li s-a recomandat repaus la pat;
- Prezența trombocitopeniei (nr. de trombocite < 100 000/μL);
- Prezența semnelor de afectare multisistemică (menționate mai sus)2.
PE apare la 2-8% din sarcini și conduce la o morbiditate și mortalitate maternă și fetală semnificative. Astfel, PE reprezintă o cauză majoră de prematuritate extremă (20% din nașterile premature < 32 săptămâni) și determină de asemenea aproximativ 76000 decese materne pe an, în întreaga lume. Nu în ultimul rând, PE constituie un factor de risc pentru dezvoltarea în viitor de afecțiuni cardiovasculare și metabolice. Până în prezent nu există niciun tratament curativ. Doar inducerea travaliului și îndepărtarea placentei ameliorează simptomatologia maternă iar internarea rapidă în centre specializate reduce cu morbiditatea și mortalitatea perinatală cu 20%3.
În majoritatea cazurilor, PE apare la femeile aflate la prima sarcină. În plus, unele afecțiuni medicale asociază un risc mai mare de preeclampsie, precum HTA, diabetul zaharat și bolile renale.
PE se poate dezvolta după săptămâna 20 de sarcină și până la 48 h postpartum; cel mai frecvent este însă diagnosticată după 34 săptămâni de gestație. Boala declanșată timpuriu (< 34 săptămâni) este însoțită de un risc perinatal și complicații materne mai mari1;2.
Mecanisme patogenice – rolul factorilor angiogenici
Deși mecanismul patogenic al preeclampsiei nu este complet elucidat, se consideră că manifestările clinice ale bolii sunt rezultatul răspunsului matern la placentația anormală. Mai mulți factori imunologici și genetici sunt implicați precoce în sarcină, alături de ischemia placentei, stresul oxidativ și alți factori ce conduc la anomalii vasculare, disfuncția celulelor trofoblastice, implantarea anormală a placentei și rezistența crescută la nivelul arterelor uterine. Hipoperfuzia placentei și stresul oxidativ local vor genera compuși polipeptidici activi ce vor ajunge în circulația maternă și vor produce un spasm al arterelor sistemice mici, cu ischemia organelor țintă4.
La începutul acestei decade, mai multe studii diferite au arătat că gravidele afectate de PE prezintă un dezechilibru între factorii plasmatici solubili antiangiogenici și cei proangiogenici, acesta conducând la o disfuncție endotelială generalizată. Factorii proangiogenici circulanți secretați de placentă includ VEGF (factorul de creștere a endoteliului vascular) și PIGF (factorul de creștere placentar), în timp ce factorii antiangiogenici sunt reprezentați de sFlt1 (tirozin kinază-1 fms solubilă sau receptorul 1 pentru factorul de creștere a endoteliului vascular VEGFR-1) și sEng (endoglina solubilă).
VEGF și PIGF promovează angiogeneza prin interacțiunea cu familia de receptori ai VEGF. Deși ambii factori sunt produși de placentă, în sarcină se înregistrează creșteri semnificativ mai mari de PIGF. Astfel, în sarcina normală concentrațiile serice de PlGF cresc în primele două trimestre și scad pe măsură ce sarcina se apropie de termen, acest factor asigurând funcționarea adecvată a placentei. sFlt-1 reprezintă o izoformă solubilă a Flt-1, receptorul transmembranar al VEGF. Deși receptorului sFlt-1 îi lipsește domeniul transmembranar, acesta conține regiunea de atașare a ligandului și este capabil să lege factorii VEGF și PlGF.
Prin blocarea interacțiunii acestor factori de creștere cu receptorii transmembranari sFlt-1 exercită un efect antiangiogenic. În mod fiziologic, concentrațiile sFlt-1 rămân stabile în stadiile timpurii și mijlocii ale gestației și cresc constant până la termen, ceea ce explică rolul acestei proteine în întreruperea sarcinii în ultimile săptămâni de gestație.
La gravidele cu o remodelare vasculară uterină anormală statusul hipoxic al placentei este responsabil de eliberarea în circulația maternă a unor cantități foarte mari de sFlt-1 (figura 1), având ca rezultat scăderea biodisponibilității VEGF și PlGF și, consecutiv, inhibarea efectelor acestora asupra endoteliului matern5;6;7. Așa cum au demonstrat studiile efectuate pe modele animale, creșterea nivelurilor sFlt-1 în circulație și scăderea biodisponibilității PlGF vor avea ca rezultat apariția semnelor caracteristice PE (HTA, proteinurie), ilustrând rolul acestor factori în patogenia PE8.
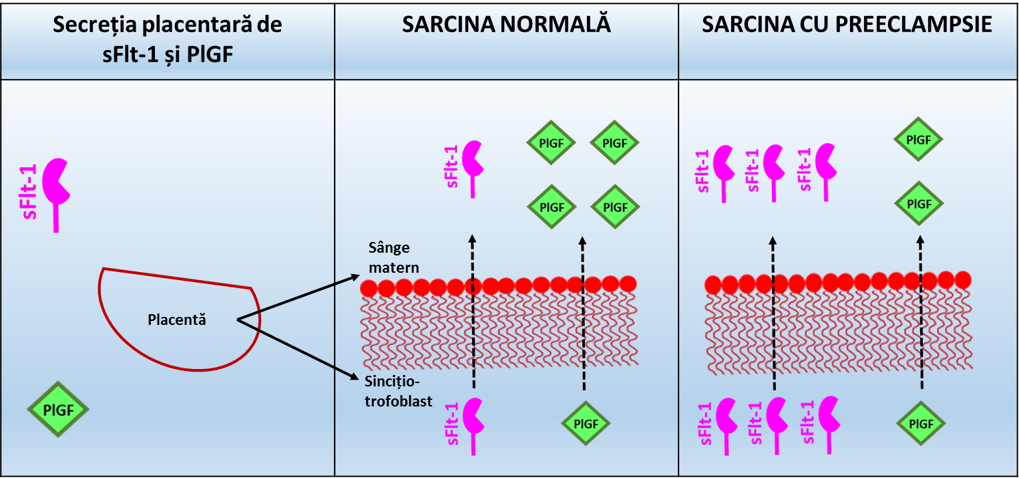

Figura 1. Factorii angiogenici placentari în preeclampsie
(Adaptare după Lecarpentier E, Tsatsaris V, 2016)
Necesitatea îmbunătățirii diagnosticului și managementului gravidelor cu PE
Diagnosticul PE se bazează pe apariția HTA și a proteinuriei în trimestrul II de sarcină, deși prezența acestora nu precede întotdeauna debutul complicațiilor și nu are valoare predictivă asupra modului de evoluție a PE. Aceste limitări conduc la o diagnosticare a PE într-un stadiu avansat de boală și posibil la complicații severe materne și fetale. Pe de altă parte, multe gravide cu semne și simptome de PE sunt spitalizate în mod nenecesar în vederea monitorizării, spitalizarea reprezentând un factor de stres pentru paciente.
Din aceste motive, este necesar să se implementeze teste de diagnostic in vitro, cum ar fi raportul sFlt-1/PlGF, pentru a îmbunătăți capacitatea de predicție, diagnosticul și prognosticul pacientelor cu PE9.
Valoarea predictivă și diagnostică a raportului sFlt-1/PlGF
Studiile prospective longitudinale au arătat că gravidele care vor dezvolta PE prezintă niveluri circulante sFlt-1 crescute și PlGF scăzute cu câteva săptămâni înainte de debutul clinic a bolii, comparativ cu gravidele care au evoluție normală a sarcinii. În plus, raportul sFlt-1/PlGF se corelează cu severitatea PE10.
Într-un studiu prospectiv multicentric de tip observațional (PROGNOSIS) ce a inclus 500 gravide cu vârstă a sarcinii între 24 +0 și 36 + 6 săptămâni și suspiciune clinică de PE, a fost identificată o valoare cut-off a raportului sFlt-1/PlGF de 38 ca având o relevanță predictivă importantă. Într-o etapă ulterioară de validare a studiului pe un lot adițional de 550 gravide, un raport sFlt-1/PlGF ≤ 38 a avut o valoare predictivă negativă (VPN) de 99.3% privind absența PE în următoarea săptămână de la momentul testării.
Pe de altă parte, un raport sFlt-1/PlGF > 38 a avut o valoare predictivă pozitivă (VPP) de 36.7%, sensibilitate de 66.2% și specificitate de 78.3% în ceea ce privește dezvoltarea PE în următoarele 4 săptămâni, subliniindu-se astfel valoarea predictivă a sFlt-1/PlGF pe termen scurt11. Într-o analiză post-hoc a datelor obținute din studiul PROGNOSIS s-a arătat că un raport sFlt-1/PlGF ≤ 38 poate exclude PE în următoarele 2, 3 și 4 săptămâni de la testarea inițială, având o VPN negativă de 97.9%, 95.7% și respectiv 94.3%. De asemenea, s-a constatat că gravidele care au dezvoltat PE și/sau evoluție nefavorabilă a fătului au prezentat o creștere semnificativă a raportului sFlt-1/PlGF la repetarea testării după 2-3 săptămâni de la determinarea inițială12.
Raportul sFlt-1/PlGF a fost aprobat pentru utilizarea în diagnosticul PE împreună cu celelalte date clinice. A fost inclus în ghidul german pentru diagnosticul afecțiunilor hipertensive13 și de asemenea în ghidul NICE (National Institute for Health and Care Excellence, UK) ca instrument de excludere a PE la gravidele cu vârstă a sarcinii între 20 și 34+6 săptămâni14.
Aplicațiile clinice ale raportului sFlt-1/PlGF
Predicția sau excluderea PE la gravidele cu factori de risc
Principalii factori de risc pentru PE sunt următorii:
- preeclampsie anterioară;
- sarcină multiplă;
- condiții medicale preexistente: HTA, boală cronică de rinichi, diabet zaharat tip 1, sindrom antifosfolipidic, lupus
eritematos sisemic.
- primiparitate;
- antecedente familiale de preeclampsie (mamă sau soră);
- obezitate;
- vârsta ≥ 40 ani;
- istoric de trombofilie;
- fertilizarea in vitro;
- velocimetrie Doppler a arterelor uterine modificată (după săptămâna 24)2;5;15.
Triajul pacientelor cu afecțiuni hipertensive asociate sarcinii
Determinarea raportului sFlt-1/PIGF poate fi utilă la gravidele cu HTA pentru a evalua necesitatea spitalizării, mai ales dacă:
- sunt prezente simptome sau semne nespecifice de PE (durere epigastrică, edem facial, creștere bruscă în greutate, cefalee, tulburări de vedere, trombocitopenie, creșterea transaminazelor serice);
- este necesar diagnosticul diferențial cu alte afecțiuni caracterizate prin proteinurie (boală cronică de rinichi ce a devenit manifestă în cursul sarcinii);
- este necesar diagnosticul diferențial între o patologie cronică și PE care s-a dezvoltat pe acest fond;
- a fost diagnosticată o restricție de creștere intrauterină5.
Evaluarea severității bolii
La pacientele spitalizate raportul sFlt-1/PIGF poate fi repetat după 48 ore: creșterea bruscă a raportului indică o agravare a condiției clinice, în timp ce o valoare stabilă asigură medicul obstetrician că starea pacientei nu se va deteriora rapid și permite repetarea testului după 2 săptămâni5.
Predicția unei evoluții nefavorabile materne sau fetale
La pacientele spitalizate măsurarea repetată a raportului sFlt-1/PIGF poate stratifica gravidele în funcție de riscul moderat, mare și foarte mare de a dezvolta o complicație5.
Specimen recoltat – sânge venos16.
Recipient de recoltare – vacutainer fără anticoagulant, cu/fără gel separator16.
Prelucrare necesară după recoltare – se separă serul prin centrifugare;
Volum probă – minim 1 mL ser16.
Cauze de respingere a probei
- specimen hemolizat;
- specimen expus la temperatură ridicată sau contaminat bacterian16.
Stabilitate probă – serul este stabil 48 ore la 2-8°C sau 1 luna la -20°C, probele nu pot fi recongelate.
Metodă – FIA.
Limita de detecție – 10 pg/mL (sFlt-1); 3 pg/mL (PIGF)16.
Valori de referință și interpretarea rezultatelor
Sunt furnizate valori de referință pentru ambii markeri de PE16:
| Săptămâni de sarcină | sFlt-1 | PlGF |
| 14-19 | 764 – 2545 | 43-348 |
| 20-24 | 626 – 4443 | 183 – 868 |
| 25-28 | 612 – 3958 | 145 – 1000 |
| 29-33 | 697 – 3722 | 71 – 1157 |
| 34-36 | 1023 – 8492 | 41 – 752 |
| > 37 | 961 – 7524 | 37 – 750 |
Interpretarea raportului sFlt-1/PIGF16;17
PE cu debut precoce (vârsta gestațională 20 – 33 + 6 săptămâni)
| Raport sFlt-1/PIGF | Interpretare | Management |
| <38 | Excluderea PE în următoarea săptămână cu o VPN de ≈99% și în următoarele 4 săptămâni cu o VPN de ≈95% | Pacienta prezintă un risc minim de a dezvolta PE în următoarele 4 săptămâni. Nu este necesară repetarea testării decât în situația în care apare o nouă suspiciune clinică de PE. |
| 38-85 | Pacienta prezintă un risc crescut de PE (VPP ≈40%) | Monitorizare și retestare după 1-2 săptămâni. Pacienta va fi informată cu privire la simptomele de PE (doar 20% din paciente vor menține sarcina după 1 lună). |
| >85 | Probabilitate mare de PE (sensibilitate 88%, specificitate 99.5%) | Spitalizare și retestare după 2-4 zile (doar 15% din paciente vor menține sarcina după 2 săptămâni). |
| >655 | Risc foarte mare de complicații pe termen scurt și necesitate de provocare a travaliului | Monitorizare atentă în spital, administrare de corticosteroizi pentru accelerarea maturării pulmonare fetale (doar 30% din gravide vor menține sarcina după 2 zile). |
PE cu debut tardiv (vârsta gestațională >34 săptămâni)
| Raport sFlt-1/PIGF | Interpretare | Management |
| <38 | Excluderea PE în următoarea săptămână cu o VPN de ≈99% și în următoarele 4 săptămâni cu o VPN de ≈95% | Pacienta prezintă un risc minim de a dezvolta PE în următoarele 4 săptămâni. Nu este necesară repetarea testării decât în situația în care apare o nouă suspiciune clinică de PE. |
| 38-110 | Pacienta prezintă un risc crescut de PE (VPP ≈40%) | Monitorizare și retestare după 1-2 săptămâni. Pacienta va fi informată cu privire la simptomele de PE (doar 20% din paciente vor menține sarcina după 1 lună). |
| >110 | Probabilitate mare de PE (sensibilitate 58.2%, specificitate 99.5%) | Spitalizare și retestare după 2-4 zile (doar 15% din paciente vor menține sarcina după 2 săptămâni). |
| >201 | Risc foarte mare de complicații pe termen scurt și necesitate de provocare a travaliului | Monitorizare atentă în spital (doar 30% din gravide vor menține sarcina după 2 zile). |
Limite și interferențe
- Interferențe analitice
Pot produce interferențe cu unele componente ale kit-ului și conduce la rezultate neconcludente următoarele:
- tratamentul cu biotină în doze mari (>5 mg/zi); de aceea se recomandă ca recoltarea de sânge să se facă după minimum 8 ore de la ultima administrare;
- titrurile foarte crescute de anticorpi anti-streptavidină și anti-ruteniu16.
Bibliografie
- Wu P, van den Berg C, Alfirevic Z, O’Brien S, Röthlisberger M, Baker PN, Kenny LC, Kublickiene K, Duvekot JJ. Early Pregnancy Biomarkers in Pre-Eclampsia: A Systematic Review and Meta-Analysis. Int J Mol Sci. 2015 Sep 23;16(9):23035-56.
- American College of Obstetricians and Gynecologists. Task Force on Hypertension in Pregnancy. Hypertension in pregnancy. Report of the American College of Obstetricians and Gynecologists’ Task Force on Hypertension in Pregnancy. Obstet Gynecol 2013;122:1122–31.
- Steegers E.A.P., von Dadelszen P., Duvekot J.J., Pijnenborg R. Pre-eclampsia. Lancet. 2010 Aug 21;376(9741):631-44.
- Li L, Zheng Y, Zhu Y, Li J. Serum biomarkers combined with uterine artery Doppler in prediction of preeclampsia. Exp Ther Med. 2016 Oct;12(4):2515-2520.
- Di Martino D, Cetin I, Frusca T, Ferrazzi E, Fuse’ F, Gervasi MT, Plebani M, Todros T. Italian Advisory Board: sFlt-1/PlGF ratio and preeclampsia, state of the art and developments in diagnostic, therapeutic and clinical management.
- Lecarpentier E, Tsatsaris V. Angiogenic balance (sFlt-1/PlGF) and preeclampsia. Ann Endocrinol (Paris). 2016 Jun;77(2):97-100.
- Tardif C, Dumontet E, Caillon H, Misbert E, Dochez V, Masson D, Winer N. Angiogenic factors sFlt-1 and PlGF in preeclampsia: Prediction of risk and prognosis in a high-risk obstetric population. J Gynecol Obstet Hum Reprod. 2018 Jan;47(1):17-21.
- Maynard SE, Min JY, Merchan J, Lim KH, Li J, Mondal S, Libermann TA, Morgan JP, Sellke FW, Stillman IE, Epstein FH, Sukhatme VP, Karumanchi SA. Excess placental soluble fms-like tyrosine kinase 1 (sFlt1) may contribute to endothelial dysfunction, hypertension, and proteinuria in preeclampsia. J Clin Invest. 2003 Mar;111(5):649-58.
- Herraiz I, Llurba E, Verlohren S, Galindo A; Spanish Group for the Study of Angiogenic Markers in Preeclampsia. Update on the Diagnosis and Prognosis of Preeclampsia with the Aid of the sFlt-1/ PlGF Ratio in Singleton Pregnancies. Fetal Diagn Ther. 2018;43(2):81-89.
- Levine RJ, Maynard SE, Qian C, Lim KH, England LJ, Yu KF, Schisterman EF, Thadhani R, Sachs BP, Epstein FH, Sibai BM, Sukhatme VP, Karumanchi SA. Circulating angiogenic factors and the risk of preeclampsia. N Engl J Med. 2004 Feb 12;350(7):672-83. Eur J Obstet Gynecol Reprod Biol. 2016 Nov;206:70-73.
- Zeisler H, Llurba E, Chantraine F, Vatish M, Staff AC, Sennström M, Olovsson M, Brennecke SP, Stepan H, Allegranza D, Dilba P, Schoedl M, Hund M, Verlohren S. Predictive Value of the sFlt-1:PlGF Ratio in Women with Suspected Preeclampsia. N Engl J Med. 2016 Jan 7;374(1):13-22.
- Zeisler H, Llurba E, Chantraine FJ, Vatish M, Staff AC, Sennström M, Olovsson M, Brennecke SP, Stepan H, Allegranza D, Schoedl M, Grill S, Hund M, Verlohren S. The sFlt-1/PlGF Ratio: ruling out pre-eclampsia for up to 4 weeks and the value of retesting. Ultrasound Obstet Gynecol. 2018 Jul 16.
- German guideline. Available at: https://www.awmf.org/uploads/tx_szleitli-nien/015 018l_S1_Diagnostik_Therapie_hypertensiver_Schwangerschaftserk-rankungen_2014-01.pdf
- NICE National Institute for Health and Care Excellence guidelines: PlGF-based testing to help diagnose suspected pre-eclampsia (Triage PlGF test, Elecsys immunoassay sFlt-1/PlGF ratio, DELFIA Xpress PlGF 1-2-3 test, and BRAHMS sFlt-1 Kryptor/BRAHMS PlGF plus Kryptor PE ratio). May 2016.
- English FA, Kenny LC, McCarthy FP. Risk factors and effective management of preeclampsia. Integr Blood Press Control. 2015 Mar 3;8:7-12.
- Laborator Synevo. Referințele specifice tehnologiei de lucru utilizate 2018. Ref Type: Catalog.
- Stepan H, Herraiz I, Schlembach D, Verlohren S, Brennecke S, Chantraine F, Klein E, Lapaire O, Llurba E, Ramoni A, Vatish M, Wertaschnigg D, Galindo A. Implementation of the sFlt-1/PlGF ratio for prediction and diagnosis of pre-eclampsia in singleton pregnancy: implications for clinical practice. Ultrasound Obstet Gynecol. 2015 Mar;45(3):241-6.


